ANÁLISE DAS PROPRIEDADES BIOMECÂNICAS E BIOQUÍMICAS DE DOIS TENDÕES DE RATOS COM O ENVELHECIMENTO
ANALYSIS OF THE BIOMECHANICAL AND BIOCHEMICAL PROPERTIES OF TWO
RAT TENDONS WITH AGING
DOI: 10.24933/rep.v9i1.480
v. 9 n. 1 (2025)
ESQUISATTO, Marcelo Augusto Marretto1; ARO, Andrea Aparecida de2; PIMENTEL, Edson Rosa3; GOMES, Laurecir3
1Núcleo de Pesquisa em Ciências da Saúde, Centro Universitário da Fundação Hermínio Ometto –FHO, Araras, São Paulo, Brasil.2Instituto de Biociências, UNESP/RC, Rio Claro, SP, Brasil. 3Instituto de Biologia, UNICAMP, Campinas, SP, Brasil
marcelosquisatto@fho.edu.br
RESUMO. As mudanças biológicas do tecido conjuntivo com o envelhecimento afetam a fisiologia dos tendões. O objetivo deste estudo foi analisar as propriedades viscoelásticas, organização estrutural e composição química do tecido conjuntivo presente em dois tendões (CT e DDFT) de ratos machos em diferentes idades, obtidos de diferentes sítios anatômicos e sujeitos a diferentes demandas funcionais. Os principais achados deste estudo estão relacionados às mudanças nas propriedades mecânicas dos tendões (CT e DDFT) com a maturidade e que essas alterações são significativamente mais profundas no DDFT do que no CT. As propriedades de intumescimento do CT e DDFT em ácido acético e água mostraram alterações significativas com o envelhecimento e diferem entre si. O conteúdo de hidroxiprolina e glicosaminoglicanos dos tendões diminui com o envelhecimento em ambos os tendões, mas entre eles podem ser observadas diferenças significativas para os dois solventes. O estudo mostra ainda que as fibrilas de colágeno em tendões jovens apresentam diâmetro menor que nos animais mais velhos. Finalmente, as observações sobre o tipo de glicosaminoglicano mostraram que a concentração de proteoglicano do tipo dermatan-sulfato foi semelhante no CT durante o envelhecimento e é maior na maturidade no DDFT. As propriedades do tecido conjuntivo sofrem alterações durante o envelhecimento e estas dependem das demandas a que as estruturas estão sujeitas com o envelhecimento.
Palavras-chave: Colágeno; glicosaminoglicanos; variação anatômica; tecido conjuntivo.
ABSTRACT. Biological changes in connective tissue with aging affect tendon physiology. The aim of this study was to analyze the viscoelastic properties, structural organization and chemical composition of connective tissue present in two tendons (CT and DDFT) of male rats at different ages, obtained from different anatomical sites and subjected to different functional demands. The main findings of this study are related to the changes in the mechanical properties of the tendons (CT and DDFT) with maturity and that these changes are significantly more intense in DDFT than in CT. The swelling properties of CT and DDFT in acetic acid and water showed significant changes with aging and differed from each other. The hydroxyproline and glycosaminoglycan content of tendons decreased with aging in both tendons, but significant differences could be observed between them in the two solvents. The study also shows that collagen fibrils in young tendons have a smaller diameter than in older animals. Finally, observations on the type of glycosaminoglycan showed that the concentration of dermatan sulfate proteoglycan was similar in CT during aging and is higher at maturity in DDFT. The properties of connective tissue undergo changes during aging and these depend on the demands to which the structures are subjected with aging.
Keywords: Collagen; glycosaminoglycans; anatomical variation; connective tissue.
INTRODUÇÃO
As fibras de colágeno são o principal elemento mecânico encontrado nos tecidos conjuntivos e a maioria são compostas de colágenos formadores de fibrilas (tipos I, II e III) e proteoglicanos (PGs) de pequeno peso molecular (XU et al., 2022). Os colágenos fibrosos do tipo I e III, presente em tendões e ligamentos, atuam na transmição e dissipação de cargas e armazenamento de energia elástica aplicada às articulações do esqueleto em vertebrados (SCOTT; ASHE, 2006; DELABASTITA et al., 2018). As propriedades mecânicas desses tecidos mudam durante o envelhecimento, o que altera a eficiência pela qual essas funções podem ocorrer. As consequências das alterações biológicas do tecido conjuntivo incluem frouxidão articular, instabilidade tendínea e falha mecânica durante o movimento (BIRCH et al., 2016; MAGNUSSON; KJAER, 2019).
Tendões e ligamentos são estruturas hierárquicas multiunitárias que contêm fibrilas, feixes de fibrilas, fascículos e unidades de tendões que correm paralelamente ao eixo geométrico. As unidades fasciculares variam em diâmetro de vários a centenas de micrometros e contêm feixes de fibrilas e fibras de colágeno (BIRCH et al., 2016). PGs e o ácido hialurônico são modelados para inchar os espaços aquosos entre as fibrilas, limitando o colapso do tecido. Os pequenos PGs, incluindo a decorina, são considerados organizadores de tecidos, orientando e ordenando as fibrilas de colágeno (XU et al., 2022). No tendão maduro, os filamentos de PG são vistos como dispostos ortogonalmente na matriz que circunda as fibrilas de colágeno em cada período D, sugerindo que esses elementos estão envolvidos na transmissão de força (RIBITSCH et al., 2020).
A curva de tensão-deformação de tendões é caracterizada por uma região não linear de baixa tensão, uma região linear e uma região de rendimento e falha não linear. Foi demonstrado que a região de baixa tensão envolve o desfibramento de fibrilas e fibras de colágeno, bem como o início do alongamento de hélice tripla, extremidades não helicoidais e ligações cruzadas. Na região linear, o alongamento molecular e o deslizamento molecular e fibrilar são os modos predominantes de deformação que levam à desfibrilação e à falha na região de rendimento e falha após a quebra de ligações cruzadas entre as fibrilas (SIADAT et al., 2021).
A estrutura e as propriedades mecânicas dos tendões se alteram durante o envelhecimento. Aumentos significativos na rigidez e na carga final e diminuição da tensão de falha foram relatados para complexos de ligamentos durante a maturação esquelética. A literatura relata que o aumento do módulo do tendão patelar está associado ao aumento do conteúdo de colágeno insolúvel que ocorre com o aumento da idade e é consistente com a observação de uma mudança de ligações cruzadas redutíveis para ligações cruzadas de colágeno não redutíveis em ligamentos periarticulares durante o envelhecimento (BIRCH et al., 2016; SIADAT et al., 2021).
Diante do exposto, o objetivo deste estudo foi examinar as propriedades viscoelásticas, organização estrutural e composição química do tecido conjuntivo presente em dois tendões (CT e DDFT) de ratos machos sedentários em diferentes idades, obtidos de diferentes sítios anatômicos e sujeitos a diferentes demandas funcionais.
METODOLOGIA
Animais
Neste estudo, sessenta ratos machos sedentários (Rattus norvegicus albinus) foram adquiridos do Núcleo de Cirurgia Experimental da Faculdade de Medicina da Universidade Estadual de Campinas (UNICAMP). Os animais, logo após o desmame, foram reunidos em grupos de quatro animais, alojados em gaiolas de polipropileno com livre acesso a comida e água e mantidos sob temperatura (23 ± 2 °C) e umidade (55%) controladas, com ciclo claro/escuro de 12 h em biotério durante todo o período experimental. O protocolo experimental foi aprovado pelo Comitê de Ética Animal (CEUA/FHO sob o protocolo n.º 073/2018) e conduzido de acordo com as orientações técnicas preconizadas pelo Conselho Nacional de Controle de Experimentação Animal (CONCEA) e as diretrizes internacionais sobre experimentação animal e biodiversidade do National Institutes of Health (EUA).
Material biológico
Após atingirem a idade de 30, 180 e 730 dias, vinte ratos de cada grupo foram eutanaziados utilizando injeção intraperitoneal da combinação de cetamina e xilazina (300 e 30 mg/kg, respectivamente), associado à manobra de deslocamento cervical após confirmação do efeito letal dos anestésicos. Em seguida, os membros posteriores foram dissecados para coleta dos tendões calcaneares (CT) e flexores digitais profundos (DDFT) e encaminhados para análise, conforme testes experimentais descritos a seguir.
Teste mecânico
Tendões (n=10) obtidos de cinco animais das diferentes idades foram submetidos a teste mecânico em equipamento específico para avaliação da deformação elástica (Impac – São Paulo/Brasil), como descrito por Benevides e colaboradores (2004). Inicialmente, o comprimento de dez tendões de cada origem e idade foi medido. Em seguida, cada espécime foi preso ao equipamento por meio de grampos metálicos, montados no acessório extensiométrico e submetidos à carga de tração. Para evitar o ressecamento, os tendões foram mantidos úmidos com banhos de solução salina. Os tendões foram tensionados a uma velocidade constante de 2 cm/min. O valor da carga (N) foi anotado para o aumento do comprimento inicial do tendão até o ponto de ruptura. Os gráficos carga-deformação daqueles tendões que se romperam no ponto mantido pelos grampos metálicos foram descartados. As curvas de carga por deformação foram obtidas e convertidas em curvas tensão-deformação.
Teste de intumescimento
Fragmentos (n=8) do CT e DDFT obtidos de quatro animais das diferentes idades foram equilibradas em 0,15 M NaCl, 50 mM NaH2PO4 a pH 7,0 por 1 h em temperatura ambiente, secadas em papel de filtro e pesadas. Cada amostra foi então equilibrada em um volume de água 1000 vezes maior por 60 min com agitação ocasional e foi então pesada novamente. Os mesmos fragmentos foram subsequentemente equilibrados em ácido acético 3% a pH 2,5 (1000 vezes vol.) por 1 h, após o que o peso úmido de cada um deles foi determinado novamente (KOOB; VOGEL, 1987).
Quantificação dos componentes do tecido
Fragmentos (n=8) do CT e DDFT obtidos de quatro animais das diferentes idades foram digeridos com solução de papaína (40 mg/g de tecido) em tampão citrato de sódio 30 mM contendo 40 mM EDTA e 80 mM 2-mercaptoetanol em pH 3,5 por 24h a 50º C. Posteriormente, o material foi centrifugado em microcentrífuga Fischer Mod. 235V, a 8.000 rpm por 3 min. O sobrenadante contendo os glicosaminoglicanos (GAGs) foi precipitado com 2 volumes de etanol 95% por 24h a 4º C. Os GAGs foram precipitados após centrifugação, lavados com etanol 80% seguido de acetona e secos a 37º C. Os GAGs foram armazenados a 4o C para análise posterior. O conteúdo de GAGs, mg de tecido fresco, foi determinado pelo método do azul de dimetilmetileno (FARNDALE et al., 1986). A análise qualitativa dos GAGs foi realizada usando eletroforese em gel de agarose em tampão propilenodiamina (PDA) (DIETRICH; DIETRICH, 1976).
Para quantificação de hidroxiprolina (colágeno), amostras (n=8) de CT e DDFT de quatro animais de cada uma das idades foram desidratadas em estufa a 60°C por 15 h e então homogeneizadas com 100 μl de HCl 6 N para cada mg de peso seco. Em seguida, foi realizada hidrólise ácida em estufa a 130°C por 4 h. Após ajuste do pH para 7,0 com NaOH 5 M, 10 μl de cada amostra e a curva padrão de hidroxiprolina foram adicionados a uma placa de 96 poços, ambos em duplicata. Então, 90 μl de solução de Cloramina T 0,056 M foram adicionados por 25 min em temperatura ambiente, seguidos por 100 μl do reagente de Ehrlich a 60°C por 20 min. A densidade óptica foi determinada usando um espectrofotômetro a 550 nm. (STEGEMANN; STALDER, 1967).
Determinação do diâmetro das fibrilas de colágeno
Amostras (n=6) do CT e DDFT de três animais das diferentes idades foram fixadas em glutaraldeído 2,5% e ácido tânico 1% em tampão cacodilato 0,1 M a pH 7,3 por 2h. Após a fixação, o material foi enxaguado em tampão cacodilato e pós-fixado com tetróxido de ósmio 1% no mesmo tampão por 1h. A impregnação foi realizada com acetato de uranila 1% em NaCl 1,2% e sacarose 7,3% em água, durante a noite a 4º C. A desidratação foi realizada em etanol graduado e óxido de propileno. Depois disso, os fragmentos foram incluídos na resina Epon 812. Seções ultrafinas transversais foram coradas com acetato de uranila 1% e citrato de chumbo 0,1% e observadas em microscópio eletrônico de transmissão Leo 906 TEM para documentação. As imagens obtidas foram digitalizadas e analisadas pelo software SIGMA SCAN ProTM para observação e determinação do diâmetro das fibrilas (em nm).
Análise estatística
As amostras foram avaliadas pelo método de análise de variância (ANOVA) com distribuição de Fischer ao nível de significância de 5% (p < 0.05). Os dados obtidos em cada experimento foram apresentados pela média ± desvio-padrão.
RESULTADOS
Propriedades mecânicas
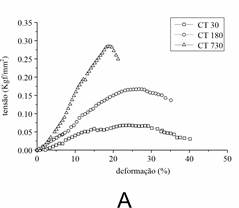
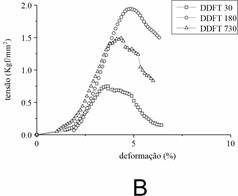
O CT e o DDFT de animais jovens, maduros e senis foram distinguíveis em suas propriedades mecânicas. A Figura 1 mostra dados típicos de tensão-deformação para CT (A) e DDFT (B). Os valores para tensão do CT foram significativamente menores do que DDFT em todas as idades. Por outro lado, a deformação suportada pelo CT foi maior do que DDFT. A falha mecânica no CT ocorreu em altas deformações e baixa tensão do que em comparação com DDFT. O CT de animais senis apresentou o alto valor de tensão. Por outro lado, o DDFT maduro demonstrou maior valor de tensão entre as idades.
Figura 1. Curvas Tensão-deformação (stress-strain) do CT (A) e DDFT (B) em diferentes idades. Foram utilizados dez tendões obtidos de cinco animais de cada idade. Os pontos representam a média dos dados obtidos a partir da análise das amostras em cada idade. Os dados foram avaliados por ANOVA (p < 0.05).
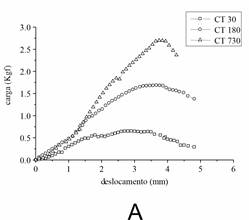
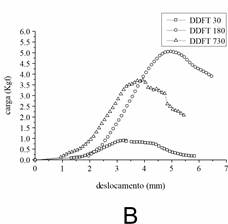
A curva carga-deslocamento (Figura 2) mostrou uma deformação semelhante, na tensão de falha, do CT (A) em todas as idades, mas o DDFT maduro (B) apresentou uma alteração maior entre os outros. Além disso, um aumento progressivo de carga foi observado no envelhecimento do CT. No DDFT foi observada uma diferença notável entre as idades. Os animais maduros apresentaram um valor mais proeminente para carga, enquanto os mais velhos um intermediário e os jovens um menor.
Figura
2.
Curvas Carga-deslocamento (load-displacement) CT (A) e DDFT (B) em
diferentes idades. Foram utilizados dez tendões obtidos de cinco animais de
cada idade. Os pontos representam a média dos dados obtidos a partir da análise
das amostras em cada idade. Os dados foram avaliados por ANOVA (p < 0.05).
A
A Tabela 1 apresenta os valores médios das propriedades mecânicas dos tendões por idade. A carga máxima de falhas mecânicas no CT apresentou um aumento progressivo de animais jovens para senis. Os dados do DDFT mostraram um rápido aumento de carga de animais jovens para adultos, mas entre animais adultos e senis não houve diferença. Quando comparados os dois tendões, os valores foram mais proeminentes no DDFT em todas as idades. Dados semelhantes foram observados para a resistência máxima ao estresse. A área da secção transversal é um parâmetro importante para determinar as propriedades mecânicas. As medidas do CT mostraram valores mais significativos em relação ao DDFT. Nenhuma diferença foi observada em ambos os tendões em relação à idade. A deformação máxima foi significativamente maior no CT. Em relação à idade, o CT apresentou valores semelhantes entre os tendões jovens e maduros e menor nos idosos. O DDFT não apresentou diferenças. O deslocamento máximo foi observado no DDFT. Entre as idades, os tendões maduros apresentaram valores maiores em relação aos demais.
Tabela 1. Valores referentes às propriedades mecânicas dos tendões por idade. Foram utilizados dez tendões obtidos de cinco animais de cada idade. Os dados estão apresentados pela média ±desvio-padrão e foram analisados por ANOVA (p < 0.05).
|
Tendão |
Idades (dias) |
Carga máxima (Kgf) |
Deslocamento máximo (mm) |
Área de secção transversa (mm2) |
Resistência máxima à tensão (Kgf/mm2) |
Deformação máxima (%)
|
|
CT
|
30 |
0,72 ± 0,17 |
4,35 ± 0,38 |
9,61 ± 0,57 |
0,07 ± 0,01 |
36,34 ± 8,39 |
|
180 |
1,84 ± 0,41 |
4,81 ± 0,24 |
10,11 ± 1,55 |
0,18 ± 0,04 |
35,06 ± 7,64 |
|
|
730 |
2,85 ± 0,91 |
4,26 ± 0,09 |
9,51 ± 0,68 |
0,30 ± 0,09 |
21,24 ± 5,25 |
|
|
DDFT |
30 |
1,09 ± 0,52 |
5,83 ± 0,50 |
1,21 ± 0,35 |
0,91 ± 0,43 |
6,43 ± 0,87 |
|
180 |
5,12 ± 1,98 |
6,46 ± 1,67 |
2,61 ± 0,40 |
1,97 ± 0,76 |
6,31 ± 1,36 |
|
|
730 |
5,06 ± 1,12 |
5,44 ± 0,89 |
2,51 ± 0,51 |
2,02 ± 0,45 |
6,01 ± 0,80 |
Testes de intumescimento
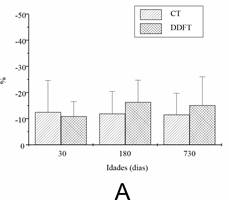
Os incrementos do intumescimento para as diferentes idades do CT e DDFT são mostrados na Figura 3. Quando os tendões foram transferidos de PBS para água destilada (Figura 3A), observou-se uma diminuição no peso úmido em todas as idades. Nenhuma diferença foi detectada entre os tendões e as idades. O comportamento oposto foi observado quando os tendões foram imersos em ácido acético (Figura 3B). O peso úmido aumentou mais acentuadamente no DDFT jovem e maduro. Nenhuma diferença significativa foi observada entre as idades do CT.
Figura 3. Teste de intumescimento de CT e DDFT com diferentes idades após tratamento com água destilada (A) e ácido acético (B). Foram utilizados oito tendões obtidos de quatro animais de cada idade. Os dados estão apresentados pela média ±desvio-padrão e foram avaliados por ANOVA (p < 0.05).
Quantificação dos componentes do tecido
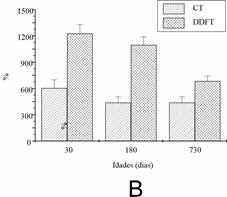
A quantidade total de GAG sulfatados do tecido úmido foi determinada a partir do CT e do DDFT (Figura 4A). A quantidade de GAGs sulfatados foi maior no CT em todas as idades. A quantidade de GAGs no DDFT foi semelhante durante o envelhecimento, mas no CT o valor mais alto foi detectado em animais maduros. Apenas o dermatam-sulfato (DS) foi detectado em todos os tendões e idades (Figura 5). O conteúdo relativo de colágeno foi determinado pela concentração de hidroxiprolina (Figura 4B). A quantidade de hidroxiprolina foi maior no CT em animais jovens. A quantidade de hidroxiprolina no DDFT foi semelhante em animais jovens e maduros, diminuindo nos mais velhos. No CT, o valor mais alto foi detectado em animais jovens e reduzido nos mais velhos.
Figura 4. Conteúdo de glicosaminoglicanos sulfatados (A) e hidroxiprolina (B) em CT e DDFT com diferentes idades. Foram utilizados oito tendões obtidos de quatro animais de cada idade. Os dados estão apresentados pela média ±desvio-padrão e foram avaliados por ANOVA (p < 0.05). A quantidade de GAGs sulfatados foi maior em CT em todas as idades.
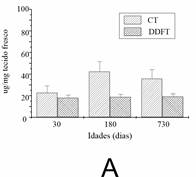
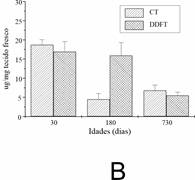
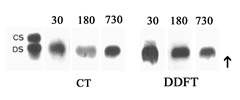
Figura 5. Eletroforese em gel de agarose para glicosaminoglicanos sulfatados obtidos de CT e DDFT com 30, 180 e 730 dias de idade. Apenas o dermatam-sulfato (DS) foi detectado em todos os tendões e idades. A seta indica a direção da corrente elétrica. CS- condroitim-sulfato, DS – dermatam-sulfato.
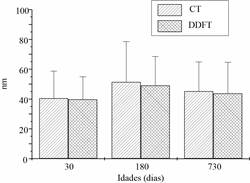
Diâmetro das Fibrilas de Colágeno
As análises do diâmetro das fibrilas de colágeno por CT e DDFT mostraram os valores mais proeminentes em animais maduros (Figura 6). Os animais jovens e senis apresentaram diâmetros de fibrilas semelhantes. Nenhuma diferença significativa foi detectada entre CT e DDFT em cada idade.
Figura 6. Diâmetro das fibrilas de colágeno observado em CT e DDFT com 30, 180 e 730 dias de idade. Foram utilizados seis tendões obtidos de três animais de cada idade. Os dados estão apresentados pela média ±desvio-padrão e foram avaliados por ANOVA (p < 0.05).
DISCUSSÃO
As propriedades mecânicas do CT e DDFT de ratos mudam drasticamente do nascimento à maturidade e essas mudanças são significativamente maiores no DDFT do que no CT. Este estudo demonstra que há mudanças mecânicas diferenciais, relacionadas à idade, em tendões anatomicamente distintos e mesmo presente em um mesmo segmento. Estruturalmente, o CT e o DDFT do rato senil são claramente diferentes um do outro e daqueles do animal jovem. Em animais jovens, ambos os tendões têm propriedades mecânicas semelhantes, exibindo extensibilidade muito maior e módulo de elasticidade e resistência à tração muito menores do que os típicos dos tendões adultos (KWAN et al., 2023). Com o crescimento e o envelhecimento, todas essas propriedades se alteram, de modo que os tendões maduros são muito mais rígidos, menos extensíveis e mais resilientes do que os mais jovens. Além disso, essas alterações elásticas ocorrem em um grau significativamente maior na principal carga de suporte no DDFT que no CT. Em animais adultos, o DDFT apresenta resistência à tração e módulo de elasticidade maiores que o CT.
As propriedades mecânicas do DDFT do rato adulto são muito próximas às de outros tendões de mamíferos adultos, como os de cavalo (RIEMERSMA & SCHAMHARDT, 1985), jumento (BENNET et al., 1986), ovelha (KER, 1981), cães (HAUT et al., 1992) e camelo (ALEXANDER et al., 1982). Esses estudos mostraram que os tendões adultos sofrem altas tensões durante a locomoção. Por outro lado, as propriedades mecânicas dos tendões que são submetidos a condições de baixa tensão in vivo apresentam dados experimentais em testes biomecânicos abaixo dos parâmetros observados nos tendões mantidos em constante exigência funcional. Esta observação foi descrita por Woo e colaboradores (1981 e 1982), que descobriram que a resistência à tração e a rigidez dos tendões flexores de suínos eram cerca de duas vezes maiores que as dos tendões extensores correspondentes.
Nenhum padrão claro surgiu em relação às diferenças entre os tendões de mamíferos de diferentes sítios anatômicos. Em um estudo com membros inferiores humanos amputados, Blanton e Biggs (1970) relataram que os tendões flexores digitais eram mais resistentes do que os extensores digitais. Kent e colaboradores (1985) encontraram diferenças na estabilidade mecânica e na reticulação de colágeno entre os tendões flexores e extensores do pé de coelho. Ker e colaboradores (1988) demonstraram que os tendões extensores do membro anterior de uma vaca adulta tinham uma resistência à tração e um módulo de elasticidade indistinguíveis daqueles dos tendões flexores adultos. Diferenças em espécie, idade e nível de exercício provavelmente contribuem para a disparidade geral dessas observações. Dados revisados por Kwan et al. (2023) mostraram que exercícios de longo prazo podem aumentar as propriedades mecânicas de tração dos tendões. Os estudos de Woo e colaboradores (1981 e 1982) mostraram que um programa de exercícios de 12 meses melhorou a força e a rigidez do extensor digital de suínos, de modo que as diferenças entre flexores e extensores, observadas em controles, foram bastante reduzidas. Em outros estudos, demonstrou-se que a carga física induzida em tendões de roedores in vivo pode causar um aumento no número, diâmetro e grau de alinhamento das fibrilas (VILARTA; VIDAL, 1989) e no conteúdo de colágeno (KOVANEN et al., 1987). Em um experimento prolongado de suspensão do membro posterior, Vailas e colaboradores (1988) descobriram que o conteúdo de colágeno e PGs do tendão patelar de ratos diminuiu e concluíram que as forças de reação do solo eram necessárias para manter a homeostase dos tendões, bem como dos músculos e ossos. Há também evidências de que os tendões são mais resistentes em ratos selvagens do que em linhagens de laboratório, sugerindo o envolvimento de fatores como exercício e idade.
Além de nossas observações em tendões de ratos, alterações dependentes da idade nas propriedades mecânicas de outros tendões de mamíferos foram documentadas. Grandes mudanças na resistência à tração e no módulo de elasticidade do tendão da cauda de ratos ocorrem com o envelhecimento ( et al., 2020). A resistência à tração dos tendões humanos aumenta de bebês a adultos (BIRCH et al., 2016). Da mesma forma, a resistência e a rigidez dos ligamentos colágenos e da pele geralmente aumentam do nascimento à maturidade, bem como durante o reparo de feridas (SIADAT et al., 2021). A redução da extensibilidade e uma mudança no comportamento de falha com o envelhecimento, de uma demanda de estresse relativamente baixa para um modo frágil de alto estresse, também são típicas dos tendões da cauda de ratos ( et al., 2020). As mudanças nas propriedades mecânicas de tração dos tendões e de outros tecidos conjuntivos colágenos que ocorrem com o envelhecimento ou com o crescimento parecem estar correlacionadas com alterações morfológicas e bioquímicas (RIBITSCH et al., 2020). Estes incluem aumentos no conteúdo de colágeno, diâmetro da fibrila, estabilização da ligação cruzada covalente, redução no ângulo de crimpagem da fibrila no estado não estressado e diminuição do conteúdo de água (RIBITSCH et al., 2020; et al., 2020).
As propriedades de intumescimento do CT e DDFT de ratos apresentaram alterações significativas da juventude para a maturidade e diferem entre os dois tendões. O conteúdo de hidroxiprolina e GAGs dos tendões diminui com o envelhecimento em ambos os tendões, mas entre eles podem ser observadas diferenças em relação ao conteúdo. Os parâmetros bioquímicos são bons indicadores para explicar as mudanças mecânicas de tendões jovens para idosos em ratos. Esses resultados provavelmente resultam, em parte, do aumento da ligação cruzada de colágeno dentro das fibrilas, da redução da hidroxilação por enzimas, da insolubilidade das fibras e da redução da viscosidade do tecido pela baixa deposição de GAGs. Em relação às diferenças entre CT e DDFT, podemos creditar isso às diferenças temporais em fatores bioquímicos entre os tendões. Uma hipótese é que o aumento na ligação cruzada que normalmente ocorre no colágeno durante o crescimento e o envelhecimento pode ocorrer mais rapidamente no DDFT do que no CT, proporcionando assim as propriedades mecânicas superiores do primeiro na maturidade. Além disso, o nível de estresse experimentado in vivo pode influenciar essas alterações (SIADAT et al., 2021).
A relevância fisiológica das diferenças mecânicas entre CT e DDFT durante o envelhecimento torna-se aparente quando consideramos a média da população de fibrilas de colágeno e suas respectivas funções na locomoção. Nosso estudo mostra que fibrilas de colágeno jovens apresentam pequeno diâmetro, de acordo com descrições anteriores em tendões de outros mamíferos (HEFFERAN et al., 2025). Concordamos com a opinião de que o diâmetro pequeno e uniforme das fibrilas se deve ao estresse mínimo sobre o tendão durante esse período da vida. Na maturidade, as fibrilas de colágeno parecem ter diâmetro maior. Isso é característico de tendões maduros, adequados para suportar estresses mecânicos maiores (BIRCH et al., 2016). Fibrilas de colágeno de vários diâmetros também são uma característica de tendões de mamíferos precoces recém-nascidos (animais capazes de andar imediatamente após o nascimento). Isso corrobora com a visão de que o crescimento lateral das fibrilas de colágeno ocorre em resposta à atividade física. Além disso, nossos dados mostram uma tendência à diminuição acentuada do diâmetro médio na velhice avançada. Durante esses três períodos, as células também sofrem alterações significativas nos componentes celulares e fibrosos do CT e do DDFT, que estão intimamente relacionados ao envelhecimento e à intensidade e duração do estresse mecânico, que diferem durante os três períodos da vida considerados (et al., 2023).
Os achados relacionados ao conteúdo e os tipos de GAG mostraram que a concentração de DS-PGs foi semelhante no CT durante o envelhecimento e é maior na maturidade do DDFT. A concentração de GAG está intimamente relacionada às propriedades mecânicas dos tendões durante a maturidade e o envelhecimento (KORCARI et al., 2023). Os resultados apresentados neste artigo são consistentes com achados anteriores de que a inclusão de DS-PG (provavelmente, decorina) desempenha um papel no comportamento mecânico do tendão (STAŃCZAK et al., 2024). É possível que diferenças no conteúdo de PG, bem como diferenças no diâmetro das fibrilas de colágeno, sejam parâmetros importantes para explicar as diferenças na viscosidade e elasticidade dos tecidos.
Duas limitações devem ser consideradas no presente estudo. A primeira refere-se às condições de manutenção dos animais. Os dados das avaliações realizadas são resultado de um estudo com animais em cativeiro, que vivem com limitações de espaço e movimento. A segunda está relacionada às diferenças relacionadas ao envelhecimento e a expectativa de vida dos ratos e relação a outros mamíferos. Sendo assim, a extrapolação dos achados descritos neste estudo para humanos ou outros mamíferos deve ser cuidadosamente analisada.
CONCLUSÃO
Diante dos dados observados, é possível concluir que em ratos machos sedentários, os tendões, mesmo estando em sítios anatômicos próximos e sujeitos a ações mecânicas similares, apresentam propriedades físico-químicas diferentes e que essas também sofrem modificações com a idade, indicando uma resposta diferencial estreitamente relacionada à demanda funcional. No entanto, novos estudos envolvendo treinamentos aeróbios, de força/resistência e a combinação de exercício e imobilização poderão fornecer dados valiosos sobre a plasticidade do tecido conjuntivo e sua resposta/adaptação ao longo do envelhecimento.
AGRADECIMENTOS
Os autores agradecem a Fundação Hermínio Ometto (FHO) e a Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) pelo suporte financeiro.
REFERÊNCIAS
ALEXANDER, R.M.; MALOIY, G.M.O.; KER, R.F.; JAYES, A.S.; WARUUI, C.N. The role of tendon elasticity in the locomotion of the camel (Camelus dromedaries). Journal of Zoology (Londres), v. 198, n. 3, p. 293-313, 1982.
BENEVIDES, G.P.; PIMENTEL, E.R.; TOYAMA, M. H.; NOVELLO, J. C.; MARANGONI, S.; GOMES, L. Biochemical and Biomechanical Analysis of Tendons of Caged and Penned Chickens. Connective Tissue Research, v.45, n.6, p. 206–215, 2004.
BENNETT, M.B.; KER, R.F.; DIMERY, N.J.; ALEXANDER, R.M. Mechanical properties of various mammalian tendons. Journal of Zoology (Londres), v. 209, n. 9, p. 537-548, 1986.
BIRCH, H.L.; PEFFERS, M.J.; CLEGG, P.D. Influence of Ageing on Tendon Homeostasis. Advances in Experimental Medicine and Biology, v. 920, n. 3, p. 247-260, 2016.
BLANTON, P.L.; BIGG, N.L. Ultimate tensile strength of fetal and adult human tendons. Journal of Biomechanics, v. 3, n. 2, p. 181-189, 1970.
DELABASTITA, T.; BOGAERTS, S.; VANWANSEELE, B. Age-Related Changes in Achilles Tendon Stiffness and Impact on Functional Activities: A Systematic Review and Meta-Analysis. Journal of Aging and Physical Activity, v. 27, n. 2, p. 116–127, 2018.
DIETRICH, C.P.; DIETRICH, S.M.C. Electrophoretic behaviour of acidic mucopolysaccharides in diamine buffers. Analytical Biochemistry, v. 70, n. 4, p. 645-647, 1976.
FARNDALE, R.W.; BUTTLE, D.J.; BARRET, A.J. Improved quantitation and discrimination of sulphated glyocosaminoglycans by use of dimethylmethylene blue. Biochemica Biophysica Acta, v. 883, n. 2, p. 173-177, 1986.
HAUT, R.C.; LANCASTER, R.L.; DECAMP, C.E. Mechanical properties of the canine patellar tendon: some correlations with age and the content of collagen. Journal of Biomechanics, v. 25, n. 2, p. 163-173, 1992.
Structural Variations of Tendons: A Systematic Search and Narrative Review of Histological Differences Between Tendons, Tendon Regions, Sex, and Age. Journal Orthopaedic Research, v. 43, n. 5, p. 994-1011, 2025.
KENT, M.J.C.; LIGHT, N.D.; BAILEY, A.J. Evidence for glucose-mediated covalent cross-linking of collagen after glycosilation in vitro. Biochemical Journal, v. 225, n. 8, p. 745-752, 1985.
KER, R.F. Dynamic tensile properties of the plantaris tendon of sheep (Ovis aries). Journal Experimental Biology, v. 93, n. 3, p. 283-302, 1981.
KER, R.F.; ALEXANDER, R.M.; BENNETT, M.B. Why are mammalian tendons so thick? Journal of Zoology (Londres), v. 216, n. 3, p. 309-324, 1988.
KOOB, T.J.; VOGEL, K.G. Site-related variations in glycosaminoglycan content and swelling properties of bovine flexor tendon. Journal Orthopaedic Research, v. 5, n. 10, p. 414–424, 1987.
KORCARI, A.; SAMANTHA, J.; PRZYBELSKI, A.; GINGERY, A.; ALAYNA E.; LOISELLE, A.E. Impact of Aging on Tendon Homeostasis, Tendinopathy Development, and Impaired Healing. Connective Tissue Research, v. 64, n. 1, p. 1–13, 2023.
KOVANEN, V.; SUOMINEN, H.; PELTRONEN, L. Effects of aging and life-long physical training on collagen in slow and faster skeletal muscle in rats. Cell Tissue Research, v. 248, n. 3, p. 247-255, 1987.
Effect of Aging on Tendon Biology, Biomechanics and Implications for Treatment Approaches. International Journal of Molecular Sciences, v. 24, n. 20, e15183, 2023.
MAGNUSSON, S.P.; KJAER, M. The impact of loading, unloading, ageing and injury on the human tendon. Journal of Physiology, v. 597, n. 10, p. 1283–1298, 2019.
RIBITSCH, I.; GUELTEKIN, S.; KEITH, M.F.; MINICHMAIR, K.; PEHAM, C.; JENNER, F.; EGERBACHER, M. Age-related changes of tendon fibril micro-morphology and gene expression. Journal of Anatomy, v. 236, n. 7, p. 688–700, 2020.
RIEMERSMA, D.J.; SCHAMHARDT, H.C. In vitro mechanical properties of equine tendons in relation to cross-sectional area and collagen content. Research in Veterinary Science, v. 39, n. 3, p. 263-270, 1985.
SCOTT, A.; ASHE, M.C. Common tendinopathies in the upper and lower extremities. Current Sports Medicine Reports, v. 5, n. 3, p. 233-241, 2006.
SIADAT, S.M.; ZAMBOULIS, D.E.; THORPE, C.T.; RUBERTI, J.W.; CONNIZZO, B.K. Tendon Extracellular Matrix Assembly, Maintenance and Dysregulation Throughout Life. Advances in Experimental Medicine and Biology, v. 1348, n. 1, p. 45-103, 2021.
STAŃCZAKA, M.; KACPRZAKB, B.; GAWDAC, P. Tendon Cell Biology: Effect of Mechanical
Loading. Cellular Physiology and Biochemistry, v. 58, n. 7, p. 677-701, 2024.
Age-related changes in the physical properties, cross-linking, and glycation of collagen from mouse tail tendon. Journal Biological Chemistry, v. 295, n. 31, p.10562-10571, 2020.
STEGEMANN, H.; STALDER, K. Determination of hydroxyproline. Clinica Chimica Acta, v. 18, n. 4, p. 267–273, 1967.
VAILAS, A.C.; DELUNA, D.M.; LEWIS, L.L.; CURWIN, S.L., ROY, R.R.; ALFORD, E.K. Adaptation of bone and tendon to prolonged hindlimb suspension in rats. Journal Applied Physiology, v. 65, n. 4, p. 373-376, 1988.
VILARTA, R.; VIDAL, B.C. Anisotropic and biomechanical properties of tendons modified by exercise and denervation: Aggregation and macromolecular order in collagen bundles. Matrix Biology, v. 9, n.1, p. 55-61, 1989.
XU, X.; HA, P.; YEN, E.; LI, C.; Zheng, Z. Small Leucine-Rich Proteoglycans in Tendon Wound Healing. Advances in Wound Care, v. 11, n. 4, p. 202-214, 2022.
WOO, S.L.Y.; GOMEZ, M.A.; RITTER, M.A.; GELBERMAN, R.H.; AKESON, W.H. The effects of exercise on the biomechanical and biochemical properties of swine digital flexor tendons. Journal of Biomechanics Engineering, v. 103, n. 1, p. 51-56, 1981.
WOO, S.L.Y.; GOMEZ, M.A.; WOO, Y.K.; AKESON, W.H. Mechanical properties of tendons and ligaments. II. The relationships of immobilization and exercise on tissue remodeling. Biorheology, v. 19, n.4, p. 397-408, 1982.
Recebido em:15/04/2025
Publicado em: 30/09/2025