Morfologia do aparelho urogenital feminino de Eira barbara (Carnivora: Mustelidae)
Morphology of the female urogenital tract of Eira Barbara
(Carnivora: Mustelidae)
DOI: 10.24933/rep.v9i1.439
v. 9n. 1 (2025)
PINTO, Caio Vinicius dos Santos1; FERREIRA, Max Alex Santos1; BRANCO, Erika2; GIESE, Elane Guerreiro2; LIMA, Ana Rita2,*.
1 Discente de Iniciação Científica do Curso de Medicina Veterinária da Universidade Federal Rural da Amazônia; Av. Presidente Tancredo Neves 2501, Belém, PA 66077-530, Brasil.
2 Professora Doutora do Curso de Medicina Veterinária da Universidade Federal Rural da Amazônia; Av. Presidente Tancredo Neves 2501, Belém, PA 66077-530, Brasil.
*autor correspondente: arlimavet@gmail.com.
RESUMO. Eira barbara popularmente conhecida como irara, é um carnívoro membro da Família Mustelidae, com ampla distribuição geográfica e com grande importância ecológica devido a sua atividade predatório intensa, a qual promove equilíbrio do ecossistema. Dessa forma, a fim de fornecer mais estudo acerca da morfologia do aparelho urogenital e consequentemente auxiliar no manejo reprodutivo desta espécie, bem como promover um estudo comparativo com outros carnívoros, este trabalho visa fornecer compreensão mais ampla dos componentes do referido aparelho em Eira barbara. Nos mamíferos, o trato urinário inclui um par de rins, um par de ureteres, uma vesícula urinária e uma uretra que se abre na região entre vagina e vestíbulo. O aparelho genital feminino consiste em um par de gônadas, um par de tubas uterinas, útero, vagina e vestíbulo da vagina e como genitália externa temos a vulva. Os órgãos de interesse foram dissecados, fotografados e coletados para processamento de rotina histológica, corados pelo método de hematoxilina-eosina e tricrômico de Gomori. Os órgãos apresentaram certo grau de autólise, porém foi possível sugerir a fisiologia correlacionando as estruturas anatômicas de Eira barbara com animais domésticos e selvagens.
Palavras-chave: Anatomia; Mustelidae; aparelho urogenital feminino.
ABSTRACT. Eira barbara, popularly known as irara, is a carnivorous member of the Mustelidae Family, with wide geographic distribution and great ecological importance due to its intense predatory activity, which promotes ecosystem balance. Thus, to provide further study on the morphology of the urogenital system and consequently assist in the reproductive management of this species, as well as promoting a comparative study with other carnivores, this work aims to provide a broader understanding of the components of the said apparatus in Eira barbara. In mammals, the urinary tract includes a pair of kidneys, a pair of ureters, a urinary bladder, and a urethra that opens in the region between the vagina and vestibule. The female genital system consists of a pair of gonads, a pair of uterine tubes, uterus, vagina and vestibule of the vagina and as external genitalia we have the vulva. The organs of interest were dissected, photographed and collected for routine histological processing, stained using the hematoxylin-eosin and Gomori trichrome method. The organs showed a certain degree of autolysis; however, it was possible to suggest the physiology by correlating the anatomical structures of Eira barbara with domestic and wild animals.
Keywords: Anatomy; Mustelidae; female urogenital apparatus.
INTRODUÇÃO
A espécie Eira barbara, popularmente conhecida como papa-mel ou irara, é pertencente a classe Mammalia, ordem Carnivora e família Mustelidae. Possui corpo alongado, membros curtos e cauda longa e peluda. Podendo medir de 55 a 117 cm, somando a cauda. A sua pelagem varia de um marrom escuro e preto pela extensão do corpo e castanho claro ou acinzentado na cabeça e no pescoço com uma mancha alaranjada na região da garganta (PRESLEY, 2000).
A sua distribuição geográfica se limita a regiões tropicais e subtropicais, como Mata Atlântica, Amazônia, Pantanal e em matas de galerias. Possui habitat predominantemente florestal fazendo uso de áreas de gramíneas altas e trilhas, abrigando-se em ocos de árvores e tocas feitas por outros animais (NOWAK, 1999). A espécie recorrente no Brasil se distribui amplamente pelo território, sendo alvo de atropelamentos acidentais ou de intempéries da natureza, não possui um padrão de mortalidade significativo. Portanto, possui uma classificação Menos Preocupante (LC) na avaliação de risco de extinção da IUCN (IUCN, 2020).
Apresenta maior atividade em período diurno, rápida movimentação tanto em solo quanto no estrato arbóreo, o que facilita a captura de frutas e predação de animais, incluindo Iguanas, ninhos de Callithrix jacchus, Bradypus tridactylus, pequenos mamíferos terrestres como roedores e lagomorfos ou até mamíferos de grande porte, como os do gênero Mazana (NOWAK, 1999). Entretanto, a espécie já foi observada fazendo uso do cruzamento de vias, principalmente nos períodos de atividade sexual, em que busca expansão de seu território e de parceiros sexuais (PRESLEY, 2000).
Do ponto de vista anatômico, Eira barbara ainda é uma espécie que precisa de ampla investigação. Ainda que a literatura contemple estudos cujos achados morfológicos contribuem com abordagens clínico-cirúrgicas, manejo nutricional, manejo reprodutivo de machos, locomoção e existência de subespécies (BRANCO et al., 2013; MACEDO et al., 2014; ERCOLI et al., 2016; LIMA et al., 2018; SCHIAFFINI et al., 2020; GONÇALVES et al., 2022; SILVA et al., 2024), há uma evidente lacuna bibliográfica quando se trata da morfologia do aparelho urogenital feminino dessa espécie.
Nos mamíferos, os órgãos do sistema urinário consistem em um par de rins formadores de urina a partir da filtração do sangue; os ureteres que irão conduzir o filtrado dos rins até a vesícula urinária onde será armazenada e, posteriormente eliminada quando for conveniente pela uretra; nos casos das fêmeas, a uretra feminina se abre ventralmente na união entre vagina e vestíbulo da vagina. O aparelho genital feminino inclui um par de gônadas, os ovários, órgãos responsáveis por produzir os gametas femininos correspondentes da espécie, assim como hormônios fisiológicos da espécie; um par de tubas uterinas que irão conduzir os gametas até o útero onde os óvulos fertilizados são retidos para o seu desenvolvimento até que esteja completo; a vagina que funciona como órgão copulatório e também como canal de parto; vestíbulo, um contínuo da vagina até se abrir externamente na vulva (DYCE et al., 2019).
Nesse sentido, mesmo com o seu risco de avaliação de extinção seja considerado Menos Preocupante, se faz necessário a preservação de espécies silvestres. O seu habitat está sendo cada vez mais degradado por ações naturais ou por ações antrópicas o que leva a uma escassez de alimentos, obrigando-o explorar novos territórios e os deixando mais indefesos a caça predatória além de ficarem mais susceptíveis a acidentes (MACE et al., 2008). Dessa forma, o entendimento detalhado do sistema urogenital feminino de Eira barbara emerge como crucial para a perpetuação da espécie, como corroborado por pesquisas promissoras conduzidas por outros autores em outras espécies domésticas e selvagens, tais como Sapajus apella (LIMA et al., 2016), Eira barbara (GONÇALVES et al., 2022), Cuniculus paca (REIS et al., 2011), Alouatta guariba clamitans (VERAS et al., 2007), e Leopardus pardalis (MACHADO et al., 2020), cujos estudos contribuem significativamente para o avanço do conhecimento nessa área.
Portanto, nesse estudo, temos como objetivo abordar uma análise dos aspectos morfológicos, a respeito da macroscopia e microscopia do aparelho urogenital feminino de Eira barbara fornecendo importantes informações anatômicas para melhor entender sua morfologia contribuindo para intervenções clínicas e preservação da espécie.
METODOLOGIA
Foram utilizados três espécimes de Eira barbara fêmeas e de diferentes idades que vieram a óbito por atropelamento, foram congelados e doados ao Laboratório de Pesquisa Morfológica Animal (LaPMA), da Universidade Federal Rural da Amazônia sob a autorização SISBIO 23401. Os animais foram fixados em solução aquosa de formaldeído a 10%, por meio de injeções intramusculares, subcutâneas e intracavitárias e mantidos nesta mesma solução por um período mínimo de sete dias. Decorrido o período de fixação os animais foram dissecados com o auxílio de bisturis, tesouras e pinças objetivando a identificação dos órgãos componentes do sistema urinário e o aparelho reprodutor feminino. Para o acesso e visibilização dos órgãos dentro da cavidade, foi realizada uma incisão na linha média ventral para abertura da cavidade abdominal e pélvica, o que permitiu a remoção dos órgãos urogenitais.
As amostras dos órgãos foram enviadas para o Laboratório de Histologia e Embriologia Animal (LHEA) na UFRA - mantidas no mesmo fixador e processadas utilizando o protocolo histológico convencional de desidratações em séries crescentes de álcoois (70%-100%), diafanizado em xilol, embebido e incluído em parafina. Foram realizadas secções no tecido coletado com espessura variando entre 5 μm e 8 μm com o auxílio de um micrótomo Zeiss modelo Hyrax 25. Para facilitar a visualização e caracterização microscópica das estruturas, foram utilizadas duas técnicas de coloração: hematoxilina eosina (HE) e tricrômico de Gomori para diferenciação das estruturas dérmicas e a queratinização do epitélio da espécie (TOLOSA et al., 2003). O material, após o processamento e coloração, foi analisado e fotografado com um fotomicroscópio Leica DM 2500 com um sistema de captura de imagem digital LAS CORE.
Toda a nomenclatura adotada será baseada na Nomina Anatômica Veterinária (INTERNATIONAL COMMITEE ON VETERINARY GROSS ANATOMICAL NOMENCLATURE, 2017).
RESULTADOS E DISCUSSÃO
Conforme aludido, o estudo foi conduzido com animais atropelados e posteriormente congelados. No entanto, não conhecemos o intervalo pós-morte e tempo transcorrido de congelamento, o que impacta diretamente na conservação do material. Isso decorre do processo de autólise, que inicia poucas horas após a morte, em decorrência da liberação de enzimas potentes, armazenadas nos lisossomos (BANDARRA; SEQUEIRA, 1999).
Felizmente, os materiais investigados não apresentavam condições de autólise avançada (putrefação), permitindo que alcançássemos os resultados obtidos, ainda que de forma não totalmente satisfatória do ponto de vista microscópico. E se tratando de animais selvagens, os quais não são de fácil acesso, principalmente por serem de vida livre, é de extrema importância o total aproveitamento das carcaças, uma vez que invariavelmente a fauna é vítima do processo de antropização (VIEIRA, 2020).
Com base na conservação dos cadáveres de Eira barbara estudados, iniciamos a descrição de nossos achados pelos rins, os quais eram unilobados e assimétricos, sendo o direito mais cranial comparado ao esquerdo, situados retroperitonealmente, paralelos à coluna vertebral, envoltos por uma cápsula (Figura 1A), semelhante ao observado em cães, gatos e pequenos ruminantes (VAC, 2016; NYLAND et al., 2005; DYCE et al., 2019). Notavelmente, apresentavam uma borda lateral convexa e outra medial côncava, onde se localizava o hilo renal, ponto de entrada e saída da artéria e veia renais e ureter, como descrito para Bradypus torquatus (BIANCHI et al., 2012) e para Sapajus apella, diferindo do formato apresentado pelo rim esquerdo deste último, com a extremidade inferior afilada e a superior arredondada (LIMA et al., 2016).
Na microscopia, a cápsula de revestimento externo era formada por tecido conjuntivo fibroso e o parênquima era dividido em duas regiões: córtex e medula, onde encontravam-se distribuídos os néfrons. O córtex continha corpúsculos renais, apresentando os polos vascular, com mácula densa, e urinário com túbulos contorcidos proximais e distais, alça de Henle e ductos coletores, e a medula apresentava túbulos coletores maiores e alça de Henle, estendendo-se até a papila renal e pelve renal. Os vasos sanguíneos presentes no córtex renal incluiam arteríolas interlobulares, que se ramificavam em arteríolas aferentes que, ao alcançarem o corpúsculo renal, formavam os capilares fenestrados (Figura 2 A, B e C). Essas características são similares às observadas em mamíferos domésticos, como cães e gatos (EURELL; FRAPPIER, 2012; KÖNIG; LIEBICH, 2021; DYCE et al., 2019), e silvestres, como Galea spixii (SANTOS et al. 2014) e Sapajus apella (LIMA et al., 2016).
Os ureteres eram estruturas tubulares retroperitoneais, tendo início na pelve renal, seguindo um trajeto caudo-dorsal na cavidade abdominal, terminando nos óstios ureterais internos direito e esquerdo, próximo ao colo da vesícula urinária, na região do trígono vesical, estabelecendo um canal de comunicação entre os rins e a vesícula urinária (Figura 1A), conforme descrito para cães, gatos e ruminantes (DYCE et al., 2019) e primatas como o S. apella (LIMA et al., 2016). Na microscopia, notou-se as quatro túnicas, sendo a mucosa revestida por epitélio de transição, adjacente a túnica submucosa, composta por tecido conjuntivo frouxo e a túnica muscular formada por tecido muscular liso e, externamente, os ureteres são envolvidos pela túnica adventícia, composta por tecido conjuntivo fibroso, com tecido adiposo adjacente (Figura 2 D), sendo este padrão histológico comum em diversas espécies (LIMA et al., 2016; SANTOS et al., 2014; EURELL; FRAPPIER, 2012).
A vesícula urinária da irara estava localizada na cavidade pélvica, assumindo forma globosa e caráter distensível, variando sua forma e dimensão, entretanto, mantendo íntima relação com o útero e intestino grosso (Figura 1A), assim como descrito por Dyce et al., (2019) para animais domésticos. Microscopicamente, a vesícula urinária também apresentou quatro túnicas distintas: mucosa, submucosa, muscular e serosa. A túnica mucosa era pregueada, composta por um epitélio de transição, e repousava sobre uma lâmina própria de tecido conjuntivo frouxo. Abaixo, situava-se a túnica muscular, disposta em duas camadas perpendiculares e, externamente, túnica serosa composta por tecido conjuntivo, vasos sanguíneos e tecido adiposo (Figura 2 E).
As características supracitadas, também foram descritas por Lima et al. (2016) em S. apella, porém, os autores relatam a presença de três camadas musculares lisas compondo a túnica muscular, uma longitudinal interna, uma circular média e uma longitudinal externa, diferente do descrito por Santos et al. (2014) em G. spixii e dos achados em E. barbara, na presente pesquisa, em que em ambas as espécies foram identificadas somente duas camadas musculares, uma circular e outra longitudinal. De modo geral, apesar de tais divergências, Eurell e Frappier (2012) e Junqueira e Carneiro (2017) descreveram padrões histológicos semelhantes em animais domésticos e no homem respectivamente, e relatam a presença de três camadas musculares compondo a túnica muscular da vesícula urinária dos animais e do homem, mas acrescentam que estas apresentam-se mal definidas neste órgão, o que talvez explique a não identificação da terceira camada muscular na E. barbara.
A uretra localizou-se caudalmente no assoalho pélvico, abaixo do corpo do útero, atravessando de forma oblíqua a parede vaginal para abrir-se ventralmente na junção da vagina com o vestíbulo. Nesta espécie, a uretra mostrou-se bem curta e estreita, mas é uma estrutura cujo comprimento e largura variaram consideravelmente entre as espécies (Figura 2 F).
Em éguas a uretra é curta e ampla, já em vacas e porcas abre-se junto com o divertículo suburetral, enquanto em outros mamíferos, como a cadela, apresenta um tubérculo (DYCE et al., 2019). Em preá-do-nordeste, G. spixii, provenientes de cruzamento científico, foi identificada a uretra dividida em duas porções, uma pélvica e outra clitoriana, que se abre no óstio presente na extremidade do clítoris (SANTOS et al.,2014), entretanto, os autores ainda apontam a necessidade de mais estudos que expliquem a origem da uretra clitoridiana e uma possível masculinização intrauterina da fêmea.
O ovário de Eira barbara era um órgão par, fixado pelo ligamento próprio do ovário, o mesovário e mesossalpinge, de formato elipsoide e achatado e superfície lisa, envolto pela bolsa ovárica, sendo o direito mais cranial em relação ao esquerdo (Figura 1A e B), semelhante ao observado na maioria das espécies domésticas (DYCE et al., 2019), além de espécies silvestres, como Alouatta guariba clamitans (VERAS et al., 2007). Apesar de ser esperada a presença de bolsa ovárica nas espécies aqui reportadas, existe uma espécie de roedor, o ratão-do-banhado (Myocastor coypus), que não possui bolsa ovárica (FELIPE; CABODEVILA; CALLEJAS, 1999).
Na microscopia, o ovário era revestido externamente por um epitélio pavimentoso simples com túnica albugínea adjacente, seguida por uma região cortical, onde estavam localizados os folículos ovarianos primordiais, primários e secundários, envoltos pelo estroma ovariano. Os folículos primordiais caracterizaram-se pela presença do oócito envolvido pela camada folicular composta por um epitélio pavimentoso simples. Os folículos primários apresentaram camada de células foliculares cúbicas. Os folículos secundários se caracterizaram pelo oócito mais desenvolvido, revestido por células foliculares dispostas de forma estratificada, evidenciando a formação da granulosa. A região medular composta por tecido conjuntivo ricamente vascularizado (Figura 3 A e B), sendo essas características semelhante às descritas em animais domésticos (EURELL; FRAPPIER, 2012) e no homem (JUNQUEIRA; CARNEIRO, 2017), além de selvagens, como Leopardus pardalis (MACHADO et al., 2020) e S. apella (LIMA et al., 2016).
As tubas uterinas de Eira barbaram eram estruturas bilaterais, tortuosas e localizadas próximas aos ovários. Na macroscopia, não foi possível distinguir as três regiões distintas: infundíbulo, ampola e istmo, bem como relatado por Veras et al. (2007) para A. guariba clamitans. Na microscopia, a mucosa era revestida por epitélio pseudoestratificado ciliado, intensamente pregueada, com glândulas, sobre uma submucosa composta por tecido conjuntivo, vasos e nervos. Subjacente à submucosa, encontrou-se uma túnica muscular lisa com múltiplos feixes, envolta externamente por uma camada serosa delgada. Tais aspectos sugerem que a região seccionada corresponde à região entre o infundíbulo e a ampola, onde a abundância de pregas indica proximidade com o ovário (Figura 3C), conforme descrito para animais domésticos (EURELL; FRAPPIER, 2012), selvagens, como Atherurus africanus (MAYOR et al., 2002), e para o homem (JUNQUEIRA; CARNEIRO, 2017).
O útero de Eira barbara era bicórneo, dividido em cornos, corpo e cérvix, associados ao ligamento largo (Figura 1A). Este padrão é semelhante na maioria das espécies domésticas, conforme observado por Dyce et al. (2019), e de animais selvagens, como A. guariba clamitans (VERAS et al., 2007). Além disso, não possui ligamento intercornual, como observado em Cuniculus paca (REIS et al., 2011). Na microscopia, o útero era composto por três camadas: endométrio, miométrio e perimétrio. O endométrio era constituído pela mucosa revestida por epitélio colunar simples ciliado, com glândulas tubulares espaçadas, como relatado em A. africanus (MAYOR et al., 2002), dividida em porções funcional e basal, e submucosa composta por tecido conjuntivo frouxo adjacente. O miométrio correspondia a camada muscular lisa espessa, organizada em camadas, e o perimétrio apresentava serosa de tecido conjuntivo, revestida por um epitélio pavimentoso simples (folheto visceral do peritônio) (Figura 3 D). Tais características são semelhantes ao observado na maioria das espécies domésticas (EURELL; FRAPPIER, 2012).
A vagina da irara se prolongava numa posição mediana no interior da cavidade pélvica, ventralmente ao reto e dorsalmente a vesícula urinária, se comunicando com a cérvix em sua extremidade cranial e com o vestíbulo na sua extremidade caudal (Figura 1A), diferente de C. paca, cuja vagina se inicia desde a cavidade abdominal e se prolonga até a cavidade pélvica, demonstrando importante diferença topográfica, além da presença de fórnix da vagina e ausência de vestíbulo (REIS et al., 2011). Microscopicamente, a mucosa era revestida por epitélio pavimentoso estratificado queratinizado, com pregas longitudinais, adjacente a submucosa de tecido conjuntivo, e a túnica muscular apresentou diferenciação no sentido dos feixes, sendo uma circular e longitudinal, adjacente a túnica adventícia (Figura 2 E), semelhante ao descrito para Galea spixii (SANTOS et al., 2014).
Como descrito por Dyce et al. (2019) para a maioria das espécies domésticas, a vulva de E. barbara era formada por duas comissuras, dorsal e ventral, com o clitóris, entretanto, na macroscopia, este não foi identificado de maneira clara na comissura ventral, sendo visualizado somente na microscopia. A partir de cortes transversais, apresentou formato cilíndrico na região interna e formato côncavo na extremidade, formado por tecido ósseo do tipo compacto, uma vez que possuía ósteons, formados por canais de Havers envoltos por lamelas concêntricas, semelhante ao osso peniano identificado nos machos dessa espécie, que revelou formato e organização histológica semelhante (GONÇALVES et al., 2022), indicando uma origem embriológica comum (Figura 1C e Figura 3F).
Figura 1- Fotomacrografias do aparelho urogenital feminino da Eira barbara. A) Rim direito (a) e esquerdo (a’), ligamento suspensor do ovário direito (b) e esquerdo (b’), ovário direito (c) e esquerdo (c’), cornos uterinos direito (d) e esquerdo (d’), vesícula urinária (e), adrenal esquerda e direita (f), ureter direito (g) e esquerdo (g’), corpo do útero (h), região de vagina e uretra (i), abertura vaginal (j). Barra de escala: 2 cm. B) Ovário envolto pela bolsa ovárica (*), sustentado pelo ligamento largo (1), ligamento próprio do ovário (2) e mesossalpinge (3). Barra de escala: 1 cm. C. Abertura vulvar (a). Barra de escala: 2 cm.
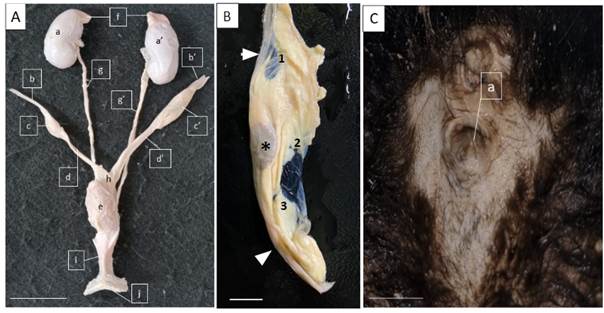
Figura 2- A) Corte histológico de rim revestido externamente pela cápsula renal (seta), sendo o parênquima divido em região cortical (1) e medular (2), sendo evidente também a pelve renal (3). Barra de escala: 2 mm. B) Córtex renal evidenciando a artéria interlobular (1) se ramificando em arteríolas aferentes (2) do glomérulo, além dos túbulos renais proximais (cabeça da seta) e distais (seta). Barra de escala: 50 Barra de escala: 50 μm. C) Corpúsculos renais evidenciando a cápsula glomerular (cabeça da seta), os polos vasculares (1) e urinário (2), os capilares fenestrados (*) e o túbulo contorcido distal com mácula densa (setas). Barra de escala: 50 μm. D) Corte transversal do ureter evidenciando as túnicas mucosa revestida por epitélio de transição (1), submucosa (2), muscular (3) e adventícia (4), com grande quantidade de tecido adiposo (*). Barra de escala: 500 μm. E) Vesícula urinária evidenciando as túnicas mucosa revestida por epitélio de transição (1), submucosa (2), espessa muscular (3) e adventícia (4). Barra de escala: 500 μm. F) Uretra evidenciando a mucosa pregueada, revestida por epitélio de transição (1), submucosa repleta de seios sanguíneos cavernosos (2) e túnica muscular envolvida por uma fina camada adventícia (3). Barra de escala: 500 μm.
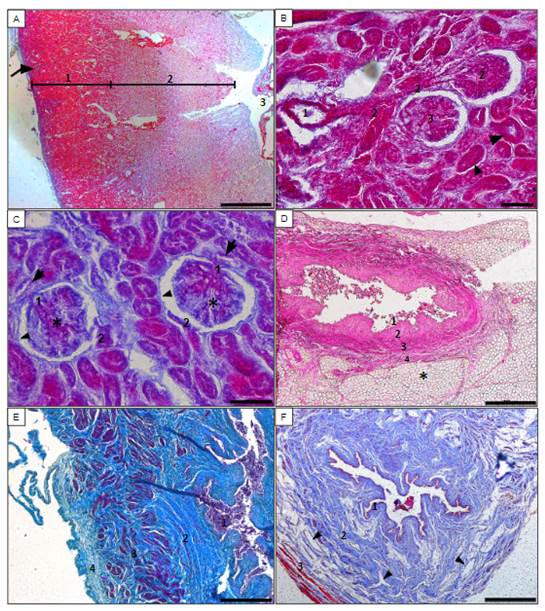
Figura 3- A) Corte histológico do ovário, revestido pela bolsa ovárica (seta) rica em tecido adiposo (*), com as tubas uterinas (cabeça da seta), sendo o parênquima ovariano dividido em zona cortical (1) e medular (2). Barra de escala: 2 mm. B) Córtex ovariano evidenciando os folículos primordial (cabeça da seta), primário (seta menor) e secundário (seta maior), envoltos pelo estroma. Barra de escala: 50 μm. C) Corte transversal da tuba uterina, evidenciando a mucosa (1) com longas pregas (cabeça da seta), submucosa (2), muscular (3) e serosa (4). Barra de escala: 200 μm. D) Corte transversal do útero evidenciando o endométrio (1) com glândulas uterinas (seta), o miométrio (2) e o perimétrio (3). Barra de escala: 100 μm. E) Vagina evidenciando as túnicas mucosa revestida por epitélio pavimentoso estratificado (1), submucosa (2) e muscular (3). Barra de escala: 500 μm. F) Osso clitoridiano compacto na região vulva, evidenciando os sistemas de Havers (seta). Barra de escala: 500 μm.
CONCLUSÃO
O aparelho urogenital feminino de Eira barbara apresentou características comuns a muitos mamíferos. Em suma, as informações obtidas proporcionaram informações valiosas sobre a anatomia e histologia dos órgãos genitais de irara, reforçando seu papel adaptativo e contribuindo para o avanço do conhecimento científico na área da morfologia comparada. As análises corroboraram com achados prévios em mamíferos domésticos e selvagens, destacando-se pela descrição detalhada das estruturas específicas encontradas nesta espécie.
Apesar das limitações do estudo sob os aspectos microscópicos em decorrência do de autólise do material, nossos achados apresentam plena condição de auxiliar médicos veterinários no âmbito da clínica médica e cirúrgica do aparelho urogenital de Eira barbara, norteando possíveis abordagens para o tratamento de afecções no referido contexto.
REFERÊNCIAS
BANKS, W.J. Histologia Veterinária Aplicada. 2. ed. São Paulo: Manole, 1991. 617 p.
BIANCHI, P.K.F. DA C.; CARDOSO, F., SALVADORI, M.L.B., LIMA, A.R., SANTOS, G. M.F., KFOURY JR, J.R. Morfologia renal do Bradypus torquatus. Revista Biotemas, 25 (4), 201-205, 2012. doi: 10.5007/2175-7925.2012v25n4p201
BRANCO, E.; LINS E LINS, F.L.M.; PEREIRA, L.C.; LIMA, A.R. Topografia do cone medular da irara (Eira barbara) e sua relevância em anestesias epidurais. Pesq. Vet. Bras. v. 33, n 6, p. 813-816, 2013. https://doi.org/10.1590/S0100-736X2013000600020
DELLMAN, H.D.; BROWN, E.M. Histologia veterinária. Rio de Janeiro: Guanabara Koogan, 1982. 397p.
DYCE K.M.; SACK W.O.; WENSING C.J.G. 2019. Tratado de Anatomia Veterinária. 5. ed. Rio de Janeiro: Elsevier, 2019.
ERCOLI, M.D.; YOULATOS, D. Integrating locomotion, postures and morphology: The case of the tayra, Eira barbara (Carnivora, Mustelidae). Mamm. Biol. v. 81, p. 464–476, 2016. https://doi.org/10.1016/j.mambio.2016.06.002
EURELL, J.A.; FRAPPIER, B. L. Histologia veterinária de Dellmann. 6. ed. Barueri: Manole, 2012.
FELIPE, A.; CABODEVILA, J.; CALLEJAS, S. Anatomical-histological characteristics of the ovary of the coypu (Myocastor coypus). Anatomia, Histologia, Embryologia, v. 28, p. 89-96, 1999.
GONÇALVES, T.C., DE SOUSA, D.F., PINTO, M.P.E., RODRIGUES, R.A.R., GIESE, E. G., BRANCO, É., LIMA, A.R. Morphology of the male reproductive tract of Eira barbara. Anatomia, Histologia, Embryologia, v. 51, p. 390-399, 2022. doi: 10.1111/ahe.12791.
HAFEZ, E.S.E.; HAFEZ, B. Reprodução Animal, 7. ed. Barueri: Manole, 2004.
HILDEBRAND, M. Análise da estrutura dos vertebrados. São Paulo: Atheneu Editora, 1995.
IUCN - International Union for Conservation of Nature. The IUCN Red List of Threatened Species. Version 2020-1. Cambridge: IUCN, 2020. Disponível em: https://www.iucnredlist.org.
INTERNATIONAL COMMITEE ON VETERINARY GROSS ANATOMICAL NOMECLATURE (2017). Nomina Anatomica Veterinaria 6. ed. Hannover, Columbia, Gent, Sapporo: Editorial Committee, 2017.
JUNQUEIRA, L.C., CARNEIRO, J. Histologia básica. 13. ed. Rio de Janeiro: Guanabara Koogan, 2017.
KÖNIG, H.E., LIEBICH, H. G. Anatomia dos Animais Domésticos: Texto e Atlas Colorido. Porto Alegre: Artmed, 2021.
LIMA, A.R., GUIMARÃES, S.B., BRANCO, É., GIESE, E.G., MUNIZ, J.A.P.C., RICCI, R.E.G., MIGLINO, M.A. Anatomia e histologia do trato urinário do macaco-prego (Sapajus apella). Pesquisa Veterinária Brasileira, v. 36, n. 3, p. 221-226, 2016. Disponível em: http://dx.doi.org/10.1590/S0100-736X2016000300012.
LIMA, A.L.S.N.; GONÇALVES, T.C.; BRANCO, E.; RODRIGUES, R.A.R.; GIESE, E.G.; CARMO, D.C.; SANTOS, J.T.; LIMA, A.R. Morphology of the Stomach of Tayra (Eira barbara). Acta Scientiae Veterinariae, v. 46:1575. https://doi.org/10.22456/1679-9216.84087
MAYOR, P., LÓPEZ-BÉJAR, M., JORI, F., RUTLLANT, J., LÓPEZ-PLANA, C., LÓPEZ- GATIUS, F. Anatomicohistological Characteristics of the Genital Tubular Organs of the Female Brush-tailed Porcupine (Atherurus africanus, Gray 1842) from Gabon. Anat. Histol. Embryol., v. 31, p. 355-361, 2002. doi: 10.1046/j.1439-0264.2002.00417.x.
MACE, G.M., COLLAR, N.J., GASTON, K.J., HILTON-TAYLOR, C., AKCAKAYA H.R., LEADER-WILLIAMS, N., MILNER-GULLAND, E., STUART, S. Quantification of extinction risk: IUCN’s system for classifying threatened species. Conservation Biology, v. 22, n. 6, p. 1424-1442, 2008. https://www.researchgate.net/publication/236679153_Quantification_of_Extinction_Risk_IUCN%27s_System_for_Classifying_Threatened_SpeciesCuantificacion_del_Riesgo_de_Extincion_Sistema_de_la_UICN_para_la_Clasificacion_de_Especies_Amenazadas
MACEDO, B.C.; BRANCO, E.; PEREIRA, L.C.; LIMA, A.R. Estudo anatômico do circuito arterial do encéfalo em Eira barbara – relato de dois casos. Biotemas, v. 27, n. 2, p. 177-183. 2014. http://dx.doi.org/10.5007/2175-7925.2014v27n2p177.
MACHADO, A.S.D. Órgãos genitais femininos do Lobo-marinho-sul-americano (Arctocephalus australis): uma abordagem morfofuncional. 2009. Tese de Doutorado. Universidade de São Paulo.
MACHADO, L.C.; ORLANDIN, J.R.; KARAM, R.G.; RÓS, F.A.; MARTINS, D.S.; COSTA, G.M.; AMBRÓSIO, C.E. Morphology of male and female reproductive tract of the ocelot (Leopardus pardalis). Animal Reproduction, v. 17, n. 2, e20200010, 2020. Disponível em: https://doi.org/10.1590/1984-3143-AR2020-0010.
NOWAK. 1999. Walker’s mammals of the world – Vol. I – 6ed. The John Hopkins University Press, Baltimore and London, 1999. 836pp.
NYLAND, T.G., MATTOON, J.S., HERRGESELL, E.J., WISNER, E.R. 2005. Baço, p.131-138. In: Nyland, T. G., Mattoon, J. S. (Eds). Ultra-Som Diagnóstico em Pequenos Animais. 2 ed. São Paulo: Roca.
PAWLINA, P.W., ROSS, M.H. Ross histologia texto e atlas. 8° ed. Rio de Janeiro: Guanabara Koogan, 2021, 1037 p.
PRESLEY, S.J. Eira barbara. Mammalian Species, n. 636, 2000, p. 1-6.
REIS, A.C.G., GERBASI, S.H.B., MARTINS, C., MACHADO, M.R.F., ALVARENGA, C. Morfologia do sistema genital feminino da paca (Cuniculus paca, Linnaeus, 1766). Braz. J. Vet. Res. Anim. Sci., v. 48, n. 3, p. 183-191, 2011. 10.11606/S1413-95962011000300001
SCHIAFFINI, M.I. Are subspecies (of Eira barbara) real? Journal of Mammalogy, v. 101, n. 5, 5, p. 1410–1425, 2020. https://doi.org/10.1093/jmammal/gyaa105
SILVA, A.M.M.; SILVA, R.P.; RODRIGUES, R.A.R.; GIESE, E.G.; LIMA, A.R.; BRANCO, E. Topografia e morfologia do diafragma de Eira barbara. BMC Zool. v. 9, 23 (2024). https://doi.org/10.1186/s40850-024-00212-0
VAC, M.H. Sistema Urinário: Rins, Ureteres, Bexiga Urinária e Uretra. In: CARVALHO, C. F. Ultrassonografia em Pequenos Animais. 2. ed. São Paulo: Roca, 2016. p. 133-182.
VERAS, M.M.; MIGLINO, M.A.; SILVA, Z. 2007. Morfologia do aparelho reprodutor em fêmeas de bugio marrom (Alouatta guariba clamitans). Brazilian Journal of Veterinary Research and Animal Science, v. 44, n. 1, p. 12-17, 2007. https://www.researchgate.net/publication/242094179_Morfologia_do_aparelho_reprodutor_em_femeas_de_bugio_marrom_Alouatta_guariba_clamitans
WELSCH U., Atlas de Histologia. 6ª ed. Rio de Janeiro: Guanabara Koogan, 2003, 266p.
YOUNG, B.; HEATH J.W. Histologia Funcional: texto e atlas. 4. ed. Rio de Janeiro: Guanabara Koogan, 2001. 415 p.
Recebido em 03/09/2024
Publicado em 22/04/2025